一、MDR簡(jiǎn)介
2017年5月5日,歐盟官方期刊(Official Journal of the European Union)正式發(fā)布了歐盟醫(yī)療器械法規(guī)(REGULATION(EU)2017/745,簡(jiǎn)稱(chēng)“MDR”)。MDR將取代Directives 90/385/EEC(有源植入類(lèi)醫(yī)療器械指令)and 93/42/EEC(醫(yī)療器械指令)。依據(jù)MDR Article 123的要求,MDR于2017年5月26日正式生效,并與2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
二、MDR的主要變化
1.擴(kuò)大了應(yīng)用范圍
2.提出了新的概念和器械的定義
3.細(xì)化了醫(yī)療器械的分類(lèi)
4.完善了器械的通用安全和性能要求
5.加強(qiáng)對(duì)技術(shù)文件的要求
6.加強(qiáng)器械上市后的監(jiān)管
7.完善臨床評(píng)價(jià)相關(guān)要求
8.提出Eudamed數(shù)據(jù)庫(kù)的建立和使用
9.提出器械的可追溯性(UDI)
10.對(duì)NB提出嚴(yán)格的要求
三、MDR適用范圍擴(kuò)大
新MDR不僅包含了MDD及AIMDD涵蓋的所有產(chǎn)品;還覆蓋專(zhuān)門(mén)用于器械的清潔、消毒或滅菌的器械,以及Annex XVI列舉的無(wú)預(yù)期醫(yī)療目的的產(chǎn)品,如美瞳、面部填充或注射、紋身、皮膚改善和美容等產(chǎn)品。
包含某些藥械結(jié)合產(chǎn)品,詳細(xì)請(qǐng)見(jiàn)Article1(8,9)。
包含某些由非活性或處理為非活性的人類(lèi)來(lái)源組織或細(xì)胞衍生物制造的特定產(chǎn)品。
包含聲稱(chēng)僅具有美容目的或另一種非醫(yī)療目的,但在功能和風(fēng)險(xiǎn)特征方面類(lèi)似于醫(yī)療器械的特定產(chǎn)品組
聲明納米材料器械屬于MDR范圍,且要接受最為嚴(yán)格的評(píng)估程序。
包含發(fā)射離子輻射的器械和醫(yī)療用途的軟件。
四、MDR提出了新的概念和器械的定義
MDR中增加了很多新的概念,從MDD中的14個(gè)概念,增加到現(xiàn)在的71個(gè),如增加了一些臨床試驗(yàn)方面和上市后監(jiān)管方面的概念,如“recall,withdraw,serious incident,clinical consent,clinical benefit”.詳情請(qǐng)見(jiàn)Article2
五、器械的分類(lèi)變化
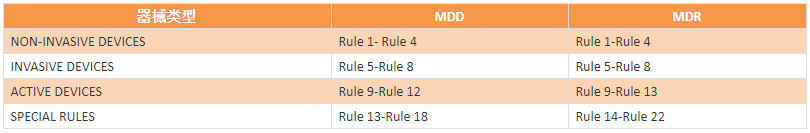
從MDD到MDR,器械仍分為四大類(lèi):I類(lèi)、IIa類(lèi)、IIb類(lèi)、III類(lèi)。
MDD中與分類(lèi)相關(guān)是93/42/EEC中的Annex IX和相應(yīng)的指南MEDDEV 2.4/1 Rev.9;新的MDR中Article51和Annex VIII詳細(xì)闡述了產(chǎn)品的分類(lèi)信息。主要變化是由MDD的“18條”,改為MDR的“22條”。
Rule1-Rule 4:NON-INVASIVE DEVICES非侵入性器械
Rule3:增加了用于體外直接從人體或人類(lèi)胚胎取下體外使用的人體細(xì)胞、組織、氣管,然后再植入或注入體內(nèi),此類(lèi)器械為III類(lèi)。
Rule 5-Rule 8:INVASIVE DEVICES侵入性器械
Rule 8:在原來(lái)的基礎(chǔ)上添加了:有源植入器械或其相關(guān)附件,乳房植入物或心臟修補(bǔ)網(wǎng)狀織物,完整或部分關(guān)節(jié)置換物,直接與脊柱接觸的椎間盤(pán)置換植入物為III類(lèi)。
Rule 9-Rule 13:ACTIVE DEVICES有源器械
Rule9:在原來(lái)的基礎(chǔ)上增加了“針對(duì)治療目的釋放電離輻射的有源器械”以及“用于控制、監(jiān)測(cè)或直接影響有源植入式器械”,這兩大類(lèi)器械均為II b類(lèi)。
Rule11:新添加,提出用于提供診斷或治療目的決策信息和監(jiān)測(cè)生理過(guò)程的軟件,均為II a類(lèi);其他軟件類(lèi)為I類(lèi)。
Rule 14-Rule 22:SPECIAL RULES特殊規(guī)則
Rule14:進(jìn)一步完善了“衍生自人體血液或血漿的醫(yī)療產(chǎn)品”分類(lèi)的要求。
Rule 18:進(jìn)一步完善“利用非活性或處理為非活性的人體或動(dòng)物源組織或細(xì)胞或其他衍生物制成的器械”的分類(lèi)要求。
Rule19:添加對(duì)納米材料器械的分類(lèi)要求。
Rule20:添加了通過(guò)吸入方式,與身體孔口相關(guān)的侵入器械的分類(lèi)。
Rule 21:添加了引入人體可吸收物質(zhì)到人體的器械。
Rule22:添加了具有集成或合并診斷功能的有源治療器械的分類(lèi)。
此外還刪除了MDD中對(duì)血袋的單獨(dú)分類(lèi)。
六、器械的通用安全和性能要求
由MDD中Annex 1 ESSENTIAL REQUIREMENTS進(jìn)一步完善為“ANNEX I GENERAL SAFETY AND PERFORMANCE REQUIREMENTS”;從原來(lái)的13個(gè)條款增加到現(xiàn)在的23個(gè),同時(shí)MDD中Article 13:Information supplied by the manufacturer在MDR中作為一個(gè)單獨(dú)的章節(jié)“CHAPTER III REQUIREMENTS REGARDING THE INFORMATION SUPPLIED WITH THE DEVICE”。細(xì)化了多條性能要求,強(qiáng)調(diào)將風(fēng)險(xiǎn)分析和管理貫穿于設(shè)計(jì)和生產(chǎn)、銷(xiāo)售、上市后監(jiān)管等整個(gè)產(chǎn)品周期中。
七、技術(shù)文件的要求
MDR中添加了對(duì)技術(shù)文件內(nèi)容的要求;且明確指出上市后監(jiān)管計(jì)劃和安全性更新報(bào)告(PSUR)都是技術(shù)文件的一部分,并要求依據(jù)上市后監(jiān)管體系收集的資料對(duì)技術(shù)文件中相應(yīng)信息進(jìn)行更新。
八、技術(shù)文件的基本內(nèi)容
器械說(shuō)明與性能指標(biāo)
包括變型和附件包含器械說(shuō)明與性能指標(biāo),以及引用的前代和類(lèi)似器械的信息。
制造商提供的信息
設(shè)計(jì)與制造信息
通用安全與性能要求
包含其符合附錄I提供的通用安全與性能要求的證明資料。
風(fēng)險(xiǎn)利益分析和風(fēng)險(xiǎn)管理
產(chǎn)品驗(yàn)證與確認(rèn)
臨床前和臨床數(shù)據(jù)(包含臨床評(píng)價(jià)計(jì)劃/報(bào)告,PMCF計(jì)劃/報(bào)告);以及針對(duì)含藥器械、人體/動(dòng)物來(lái)源組織或其衍生物制備的器械、引入人體并被吸收器械、具有測(cè)量功能器械等的相關(guān)附加信息
九、上市后監(jiān)管的技術(shù)文件
AnnexIII TECHNICAL DOCUMENTATION ON POST-MARKET SURVEILLANCE詳細(xì)說(shuō)明了要按照Article83-86編寫(xiě)上市后監(jiān)管的文件,包含上市后監(jiān)管計(jì)劃、上市后監(jiān)管報(bào)告或定期安全性更新報(bào)告(PSUR)。
十、符合性聲明文件
ANNEX IV EU DECLARATION OF CONFORMITY詳細(xì)說(shuō)明了“符合性聲明”文件包含的內(nèi)容。
十一、加強(qiáng)器械上市后監(jiān)管體系
Chapter VII POST-MARKET SURVEILLANCE,VIGILANCE AND MARKET SURVEILLANCE著重說(shuō)明上市后監(jiān)管、警戒和市場(chǎng)監(jiān)管。
建立、實(shí)施和維護(hù)上市后監(jiān)管體系(見(jiàn)Article83)。
強(qiáng)調(diào)上市后監(jiān)管體系貫穿整個(gè)生命周期,并不斷更新。
建立“上市后監(jiān)管計(jì)劃”(見(jiàn)Article84),具體內(nèi)容見(jiàn)Annex III。
I類(lèi)器械編寫(xiě)“上市后監(jiān)管報(bào)告”(見(jiàn)Article85)。
IIa、IIb和III類(lèi)器械編制“定期安全性更新報(bào)告(PSUR)”(見(jiàn)Article86)。
PSUR需定期更新并作為技術(shù)文件的一部分。
建立警戒和上市后監(jiān)管電子系統(tǒng)(見(jiàn)Article 92)。
在整個(gè)器械使用壽命期間,依據(jù)實(shí)施PMCF后取得的臨床數(shù)據(jù)對(duì)臨床評(píng)價(jià)及技術(shù)文件進(jìn)行更新(Annex XIV part B)。
十二、完善臨床評(píng)價(jià)相關(guān)要求
新法規(guī)提出:
要求根據(jù)Article61和附錄XIV partA執(zhí)行、評(píng)估、報(bào)告和更新臨床評(píng)價(jià)資料;
提出對(duì)特定III類(lèi)和IIb類(lèi)器械,CER中要考慮咨詢(xún)專(zhuān)家小組的意見(jiàn);
對(duì)植入和III類(lèi)器械,提出考慮臨床研究;
要求CER按照PMCF取得數(shù)據(jù)進(jìn)行更新;
針對(duì)III類(lèi)和可植入器械,提出了CER更新的頻率;
明確證明實(shí)質(zhì)等同性需考慮的特點(diǎn);
要求其與風(fēng)險(xiǎn)管理的相互作用
十三、Eudamed數(shù)據(jù)庫(kù)
新法規(guī)提出:
明確歐洲醫(yī)療器械數(shù)據(jù)庫(kù)(Eudamed)建立目的和包含的信息(Article 33);
信息的公開(kāi)性:
要求III類(lèi)器械和植入式器械,安全和臨床性能信息通過(guò)Eudamed向公眾開(kāi)放。
十四、提出器械的可追溯性(UDI)
除定制和研究器械外,其他器械均需建立UDI系統(tǒng);
UDI信息體現(xiàn)在標(biāo)簽或包裝上(不包含集裝箱);
UDI-DI信息需要載明于符合性聲明中(見(jiàn)Article27);
Annex VI Part B提出UDI-DI包含的信息;
可植入、重復(fù)使用、軟件、可配置器械的UDI有特殊要求(見(jiàn)Annex VI Part C)
包裝或標(biāo)簽上UDI實(shí)施的時(shí)間見(jiàn)Article123(f)。
UDI發(fā)行實(shí)體由歐盟委員會(huì)指定。
過(guò)渡性:Article 120指出“在委員會(huì)根據(jù)第27(2)條指定發(fā)行實(shí)體前,GS1、HIBCC和ICCBBA應(yīng)被視為指定的發(fā)行實(shí)體”。
十五、對(duì)NB提出的嚴(yán)格要求
對(duì)“公告機(jī)構(gòu)”,新版MDR花費(fèi)大篇幅對(duì)其進(jìn)行職能和要求進(jìn)行描述;各NB需按照附錄VII的要求重新申請(qǐng)MDR的三方審核的授權(quán)
十六、其它變化
EU還對(duì)一次性使用器械及其再處理(Article17)和給患者的植入器械植入物卡(Article18)提出了要求。

 掃一掃加工程師微信
掃一掃加工程師微信